從實驗室的瓶頸到 AI 的新大陸:一場結構生物學的革命
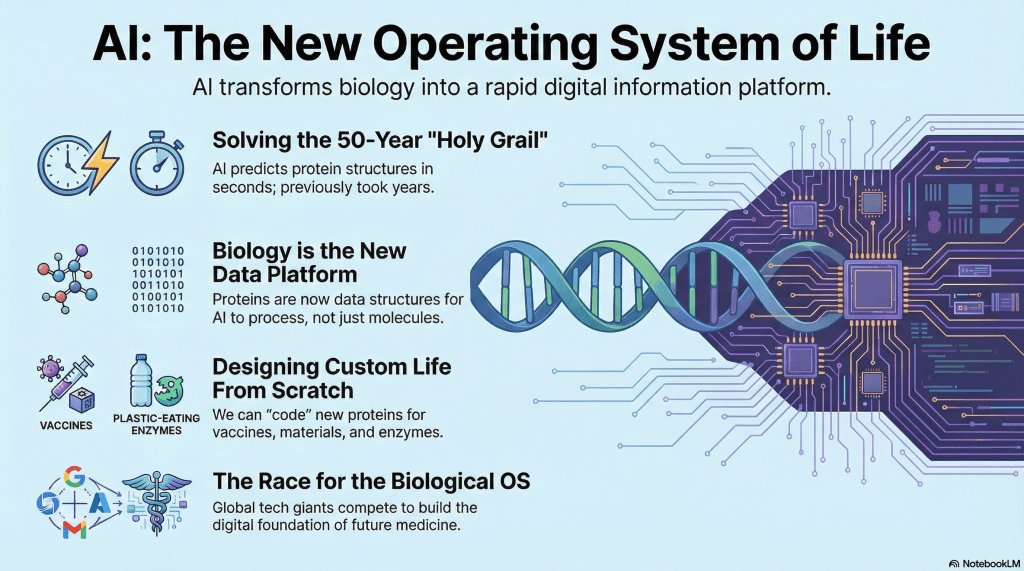
在過去的半個世紀裡,解開蛋白質的 3D 結構是生物學中最艱鉅的挑戰之一。科學家們依賴 X 射線晶體學、核磁共振學(NMR)或冷凍電子顯微鏡(Cryo-EM)等精密且昂貴的實驗技術,耗費數月甚至數年的時間,才能艱難地解析出單一個蛋白質的三維立體樣貌。這創造了一個巨大的「結構鴻溝」:我們擁有的已知蛋白質序列(生命的「程式數位碼」)呈指數級增長,但我們實際理解其結構(「機器」的藍圖)的數量卻遠遠落後。如何從 1D 的序列預測其 3D 的結構,這個被稱為「蛋白質折疊」的難題,因此被視為是分子生物學的「聖杯」。
2024 年,諾貝爾化學獎的頒發,正式確立了這場由計算機和人工智慧引領的革命:獎項授予了 David Baker(大衛·貝克)、Demis Hassabis(德米斯·哈薩比斯)和 John M. Jumper(約翰·瓊珀)三位學者,表彰他們在蛋白質結構預測與計算機蛋白質設計方面的決定性突破。這項榮譽明確地指出,蛋白質結構預測這個曾經困擾科學界數十年的問題,其本質並非無法突破的生物奧秘,而是一個可以用 AI 與超級運算解決的「巨型資訊問題」。這不僅是科學的勝利,更開啟了一扇通往全新產業的大門。
這項技術的吸引力之所以能讓全球大型 IT 公司紛紛投入開發,關鍵在於它不僅是一項生物學上的突破,更是資訊科學與產業格局的巨大轉折點。
🎯 諾貝爾級的兩大突破點
- 成就一:蛋白質結構預測
由 Google DeepMind 的 Demis Hassabis 與 John M. Jumper 開發的 AlphaFold 已經證明,能以接近實驗的準確度,從胺基酸序列預測出蛋白質的 3D 結構,解決了困擾科學界 50 年的難題。 - 成就二:電腦蛋白質設計
David Baker 教授則以其 Rosetta 軟體套件,開創了「從零開始設計」自然界中不存在的新功能蛋白質,例如新型疫苗或塑膠分解酶,這代表人類已能掌握生命的「積木」。
這場競賽很快就超越傳統學術領域,變成全球科技巨頭的新戰場。目前除了 Google(DeepMind)之外,Meta、Microsoft早已在類似的技術上積極佈局;最近連 Apple 也開發自家的生物結構預測與設計軟體,中國的 字节跳动 與 腾讯 也相繼投入相關研發。其餘國家目前的投入情況較不明確,但從全球科技投資的趨勢來看,它們也極可能在短期內加入競逐。這樣的現象,顯示這已不再是傳統生技公司的專屬領域,而是一場攸關「未來科技話語權」的跨國企業競爭。

💻 核心競爭力:生物即平台
對這些 IT 巨頭而言,蛋白質並不只是分子,而是一種數據結構;生物學也不僅是生命科學,更是一個等待被數位化與平台化的新世界。開發蛋白質結構預測工具,對這些企業來說有三層深遠的戰略意涵。
- 技術能力高度匹配: 這類軟體的核心是 Transformer、圖神經網絡(GNN)與多模態 AI,這正是大型 IT 公司最擅長的技術領域;他們擁有數以千計的 AI 工程師與龐大的資料處理能力,能夠有效駕馭這種規模的模型。
- 海量數據與超級算力的掌控: 要訓練這樣的模型,必須處理 PB 級的結構與序列資料庫,例如 PDB、UniProt、MGnify,而只有少數幾家全球雲端巨頭能同時提供高效能的 GPU/TPU 叢集與雲端基礎設施。
- 平台化商業模式的誘因: 對這些公司而言,最有價值的不是自己開藥,而是建立一個全球共用的生物計算平台,讓所有藥廠、生技公司與研究機構在他們的雲端上進行研發。這就像在淘金熱中「賣鏟子」一樣,他們不需要承擔藥物開發的高風險,就能穩定壟斷產業鏈的上游。
此外,掌握這樣的技術也具有極高的戰略地位與國際競爭力。它能吸引頂尖 AI 人才加入公司,讓企業形象從純商業科技,躍升為「解決人類重大挑戰」的代表。對這些企業來說,投資這項技術不僅能強化其技術品牌,更能提前卡位下一個數兆美元等級的產業──AI 驅動的生物經濟。這也意味著,未來的科技霸主不僅將掌握搜尋、社群與雲端,更會進一步掌握「生命設計」的基礎能力。
這場競賽的本質不是誰能做出一套軟體,而是誰能率先建立「生物世界的作業系統」。當這樣的技術成熟並被平台化,藥物研發、蛋白質設計、材料工程、甚至環境修復與能源產業都將被重新定義。這就是為什麼全球 IT 巨頭一個接一個地投入這項工具的開發,因為他們看到的,不只是一門技術,而是下一個主宰世界科技格局的基礎。
[註: 本文撰寫為本人輸入關鍵字、個人觀察與想法、引導架構、並由ChatGPT與Google Gemini反覆/修正,最後由Gemini輸出全文,再由本人完成文稿。]